Antibiotika können menschliche Krankheiten wie Krebs behandeln, nicht nur bakterielle Infektionen
4 min read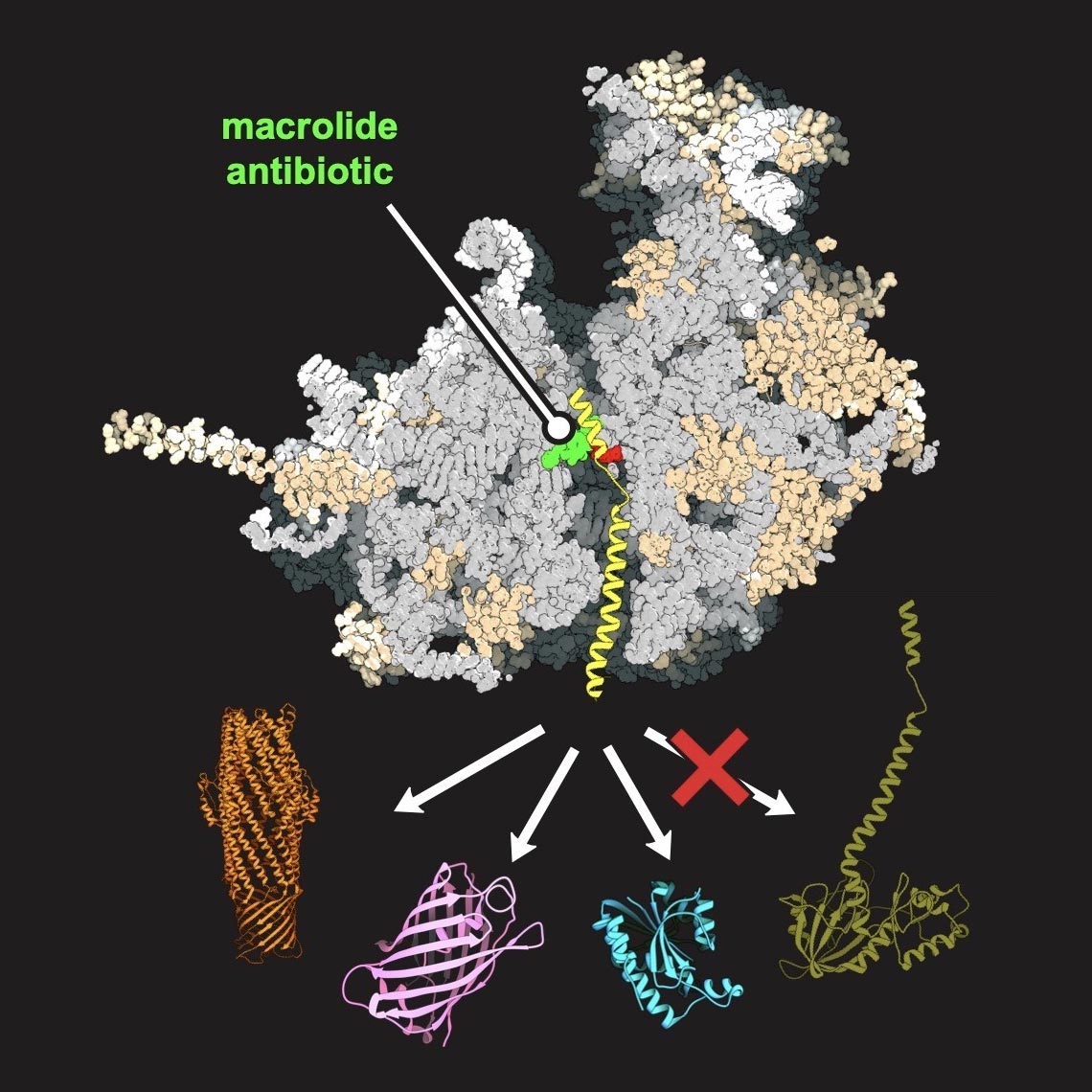

Ein Antibiotikum (grün), das mit dem Ribosom der humanen Hefe (grau) verbunden ist, ermöglicht die Synthese einiger Proteine (in Orange, Violett und Blau dargestellt), andere jedoch nicht (dunkelgrün). Bildnachweis: Maxim Svetlov / UIC
UIC-Forscher beweisen, dass für Bakterien entwickelte Medikamente das Potenzial haben, an menschlichen Zellen zu wirken.
Antibiotika, die zur Behandlung häufiger bakterieller Infektionen wie Lungenentzündung und Sinusitis verwendet werden, können laut Forschern der University of Illinois in Chicago auch zur Behandlung von menschlichen Krankheiten wie Krebs eingesetzt werden. Theoretisch zumindest.
Wie in einem neuen gezeigt Naturkommunikation Studie zeigte das Team des UIC College of Pharmacy in Laborexperimenten, dass eukaryotische Ribosomen so modifiziert werden können, dass sie auf Antibiotika genauso reagieren wie prokaryotische Ribosomen.

Alexander Mankin, Alexander Neyfakh Professor für Medizinische Chemie und Pharmakognosie am UIC College of Pharmacy. Bildnachweis: UIC Fotodienste / UIC
Pilze, Pflanzen und Tiere sind wie Menschen Eukaryoten; sie bestehen aus Zellen mit einem klar definierten Kern. Bakterien hingegen sind Prokaryonten. Sie bestehen aus Zellen, die keinen Kern haben und unterschiedliche Struktur, Größe und Eigenschaften aufweisen. Auch die Ribosomen eukaryontischer und prokaryontischer Zellen, die für die Synthese von Proteinen verantwortlich sind, die für das Zellwachstum und die Reproduktion notwendig sind, sind unterschiedlich.
„Einige Antibiotika, die zur Behandlung bakterieller Infektionen eingesetzt werden, wirken auf interessante Weise. Sie binden an das Ribosom von Bakterienzellen und hemmen sehr selektiv die Proteinsynthese. Einige Proteine dürfen hergestellt werden, andere jedoch nicht “, sagte Alexander Mankin, Alexander Neyfakh-Professor für medizinische Chemie und Pharmakognosie am UIC College of Pharmacy und Hauptautor der Studie. „Ohne diese Proteine sterben Bakterien ab. “
Wenn Menschen Antibiotika zur Behandlung einer Infektion verwenden, werden die Zellen des Patienten nicht beeinträchtigt, da die Medikamente nicht darauf ausgelegt sind, an Ribosomen anderer Form als eukaryontische Zellen zu binden.
„Da es viele menschliche Krankheiten gibt, die durch die Expression unerwünschter Proteine verursacht werden – dies ist beispielsweise bei vielen Krebsarten oder neurodegenerativen Erkrankungen üblich – wollten wir wissen, ob es möglich ist, eine Zelle mit einem Antibiotikum vor unerwünschten Proteinen zu schützen , und nur unerwünschte Proteine “, sagte Mankin.
Um diese Frage zu beantworten, wandten sich Mankin und der Erstautor der Studie, Maxim Svetlov, ein Forschungsassistent am Department of Pharmaceutical Sciences, der Hefe zu, einem Eukaryoten mit Zellen, die menschlichen Zellen ähnlich sind.

Maxim Svetlov, Forschungsassistent am Institut für Pharmazeutische Wissenschaften am UIC College of Pharmacy. Bildnachweis: Swetlow / UIC
Das Forschungsteam, zu dem auch Partner aus Deutschland und der Schweiz gehörten, habe eine “coole Sache” gemacht, sagte Mankin. “Wir haben das Hefe-Ribosom so gestaltet, dass es eher wie Bakterien aussieht.”
Das Team von Mankin und Svetlov nutzte Biochemie und Feingenetik, um über 7.000 Nukleotide in ribosomaler Hefe zu modifizieren RNA, was ausreichte, damit ein Makrolid-Antibiotikum – eine übliche Klasse von Antibiotika, die durch Bindung an bakterielle Ribosomen wirken – auf das Hefe-Ribosom einwirkte. Mithilfe dieses Hefemodells wandten die Forscher genomisches Profiling und hochauflösende Strukturanalysen an, um zu verstehen, wie jedes Protein in der Zelle synthetisiert wird und wie das Makrolid mit dem Heferibosom interagiert.
„Dank dieser Analyse haben wir verstanden, dass das Makrolid abhängig von der spezifischen genetischen Signatur eines Proteins – dem Vorhandensein einer „guten“ oder „schlechten“ Sequenz – seine Produktion am eukaryontischen Ribosom stoppen kann oder nicht“, sagte Mankin. „Dies hat uns konzeptionell gezeigt, dass Antibiotika zur selektiven Hemmung der Proteinsynthese in menschlichen Zellen und zur Behandlung von menschlichen Erkrankungen verwendet werden können, die durch ‚schlechte‘ Proteine verursacht werden.“
Die Experimente von UIC-Forschern bilden eine Plattform für zukünftige Studien. „Jetzt, da wir wissen, dass die Konzepte funktionieren, können wir nach Antibiotika suchen, die an unmodifizierte eukaryotische Ribosomen binden können, und sie optimieren, um nur Proteine zu hemmen, die für den Menschen schlecht sind“, sagte Mankin.
Referenz: „Kontextspezifische Wirkung von Makrolidantibiotika auf das eukaryotische Ribosom“ von Maxim S. Svetlov, Timm O. Koller, Sezen Meydan, Vaishnavi Shankar, Dorota Klepacki, Norbert Polacek, Nicholas R. Guydosh, Nora Vázquez-Laslop, Daniel N Wilson und Alexander S. Mankin, 14. Mai 2021, Natürliche Kommunikation.
DOI: 10.1038 / s41467-021-23068-1
Weitere Mitautoren der Studie sind Dorota Klepacki und Nora Vázquez-Laslop von der UIC; Timm Koller und Daniel Wilson von der Universität Hamburg; Sezen Meydan und Nicholas Guydosh von den National Institutes of Health; und Norbert Polacek und Vaishnavi Shankar von Universität Bern.
Diese Arbeit wurde durch Stipendien der National Institutes of Health (R35 GM127134, DK075132, 1FI2GM137845), der Deutschen Forschungsgemeinschaft (WI3285 / 6-1) und des Schweizerischen Nationalfonds (31003A_166527) unterstützt.






